专题论坛
铁死亡与细胞焦亡的区别及联系
铁死亡
定义
铁死亡是一种铁依赖的细胞死亡类型,可通过外源性途径(抑制细胞膜转运蛋白,或激活铁转运蛋白)和内源性途径(阻断细胞内抗氧化酶,如GPX4)激活。铁积累的增加、自由基的产生、脂肪酸供应和脂质过氧化增多,是诱导铁死亡的关键[1]。
特征
细胞发生铁死亡的主要形态特征,体现在线粒体的形态变化上。细胞会出现线粒体外膜破裂、体积缩小、嵴减少或消失等现象,但在整个过程中,不会出现细胞质膜的破裂等变化。
检测
依据铁死亡的特征,铁死亡检测通常包含生化特征检测、形态观察、相关基因及蛋白的检测等。其中,最常见的生化检测是细胞铁及脂质过氧化的检测。
细胞焦亡
定义
细胞焦亡(Pyroptosis)又称细胞炎性坏死,广泛参与感染性疾病和神经系统疾病的发生与发展,其经典途径为——炎症小体刺激细胞信号通路,并活化Caspase-1;Caspase-1激活IL-1β等炎症因子,切割gasdermin-D蛋白(GSDMD)的N末端,使其激活并结合到细胞膜上产生膜孔,形成细胞焦亡。此外,在一些非典型途径中,部分Caspase-11可直接与细菌的脂多糖接触激活,对GSDMD进行切割,并间接激活Caspase-1,诱发细胞焦亡。
特征
细胞焦亡的主要形态特征表现为细胞不断胀大至细胞膜破裂,在此过程中,亦会出现DNA片段化、染色质固缩、细胞骨架破坏等现象[4]。
检测
细胞焦亡的检测维度与铁死亡相同,但其常见的生化特征检测指标为Caspase-1及gasdermin-D蛋白的变化。
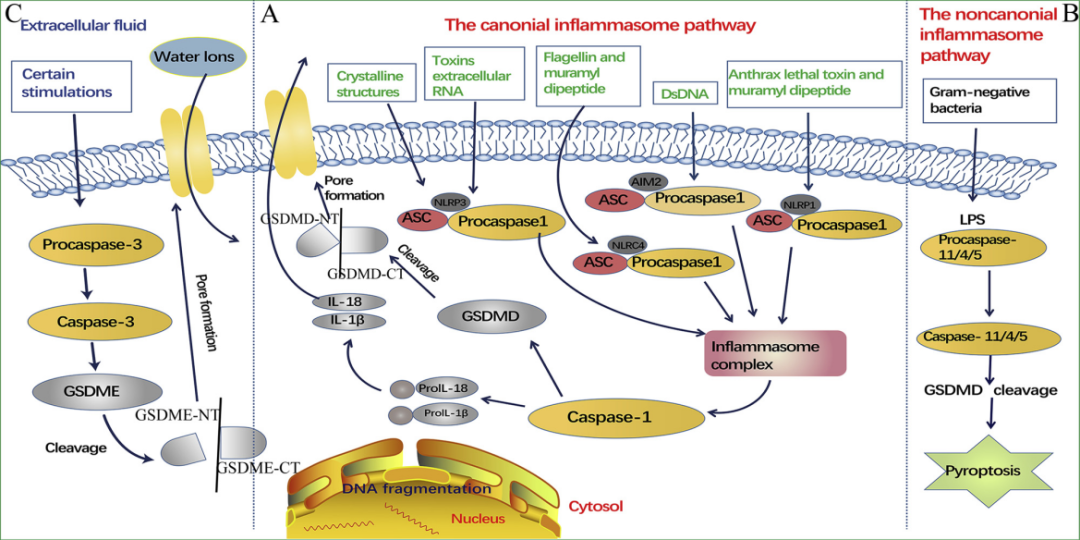
图示:细胞焦亡分子机制[5]
铁死亡与细胞焦亡的联合研究
铁死亡与细胞焦亡的各项特征存在一定区别,但两者发生的机制在肿瘤治疗领域都具有重大的研究价值。研究发现,以CD8+T细胞为代表的抗肿瘤免疫细胞,具有同时促进和诱导这两种细胞死亡方式的功能[6]。一方面,CD8+T细胞能分泌GzmA蛋白,作为GSDMB的切割酶。被切割后的GSDMB能诱导细胞焦亡的发生;另一方面,CD8+T细胞分泌的IFN-γ因子具有下调SLC7A11的功能,引起脂质ROS的积累,并诱导铁死亡的发生。
发生焦亡的肿瘤细胞会进一步促进抗肿瘤免疫细胞的功能激活与分化,促进整个肿瘤的清除,而肾癌等疾病的病变细胞对铁死亡十分敏感。临床证据表明,将诱导铁死亡作为一种治疗手段,可有效抑制患者对厄洛替尼、曲美替尼等多种药物产生抗药性[3]。铁死亡与细胞焦亡的研究,将持续助力肿瘤治疗方法的发展。
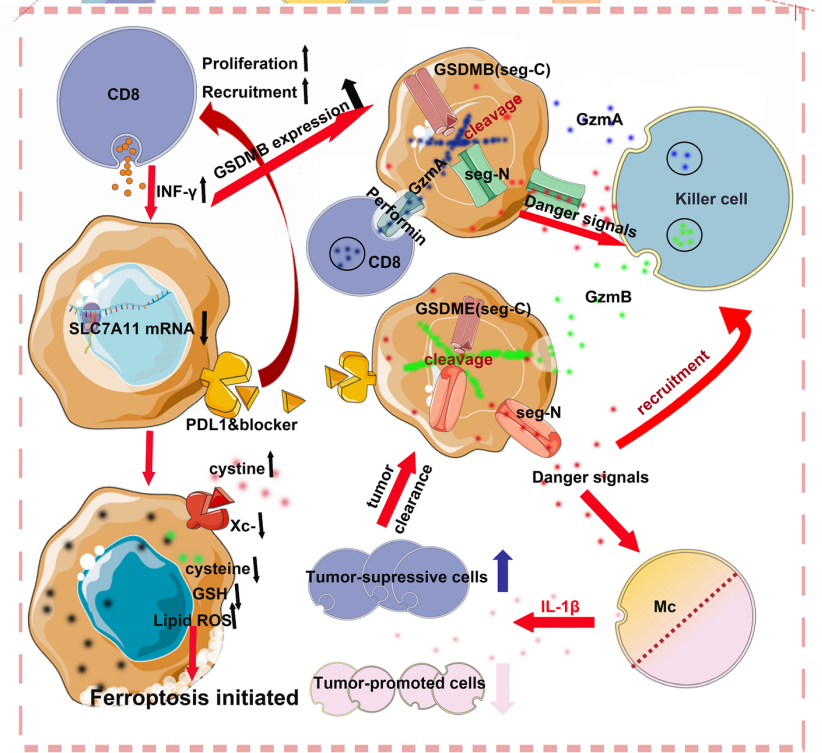
图示:CD8+T细胞促进和诱导两种细胞死亡方式的机制[6]
文献引用
1. Li J, Cao F, Yin H L, et al. Ferroptosis: past, present and future. Cell Death Dis, 2020, 11(2): 88.
2. Gnanapradeepan K, Basu S, Barnoud T, et al. The p53 tumor suppressor in the control of metabolism and ferroptosis. Frontires in Endocrinology, 2018, 9(124).
3. Chen X, Kang R, Kroemer G, et al. Broadening horizons: the role of ferroptosis in cancer. Natural Reviews Clinical Oncology. 2021, 18(5): 280-296.
4. Tao H, Tao X. Pyroptosis: a novel style of programmed cell death. Journal of Pathogen Biology, 2017(12): 1219-1221.
5. Fang Y, Tian S, Pan Y, et al. Pyroptosis: A new frontier in cancer[J]. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 2019, 121:109595.
6. Tang R, Xu J, Zhang B, et al. Ferroptosis, necroptosis, and pyroptosis in anticancer immunuty. Journal of Hematology & Oncology, 2020, 13, 110.
下一个: 铁死亡常见研究方法
