流式课堂
流式课堂 | 抗体滴定如何做?一文全解析
本篇文章收录于合集:Elabscience®流式课堂 ←点击查看更多流式实验相关文章

使用流式抗体时,抗体浓度是最关键的参数。新手老师随意添加,容易产生背景染色过深、样本浪费等问题。为了达到更好的实验效果,节约宝贵的样本,我们需要进行抗体滴定。
1 什么是抗体滴定
抗体滴定,是做流式实验之前,对所用流式抗体进行最佳的抗体用量和抗体浓度测定的实验,其目的是实现最优的信噪比,并且在多指标流式检测实验之前,对抗体配色发挥重要作用。
2. 为什么要做抗体滴定
一般情况下,生产厂家都会提供流式抗体的推荐使用量,但抗体的最佳使用浓度或“滴度”,与我们的检测目标、染色时间,以及温度、细胞是否固定等实验条件有关。
由于商业试剂不太可能在您所用的特定实验条件下进行测试,使用过多或过少的抗体,都会导致非特异性染色增加、信噪比降低、灵敏度降低、表达水平与染色强度之间缺乏线性关系等情况,增加了实验成本。因此,抗体滴定显得尤为重要。
3 如何做抗体滴定
① 抗体(以小鼠CD4为例)使用前,先12000 g离心1 min,去除底部团块。这些团块可能是抗体互相之间粘附形成的沉淀;
② 一般情况下,起始滴定浓度约10 µg/mL,做6~8个梯度。例如:抗体起始浓度为0.2 µg/µL,实验体系为100 µL,做6个浓度梯度:
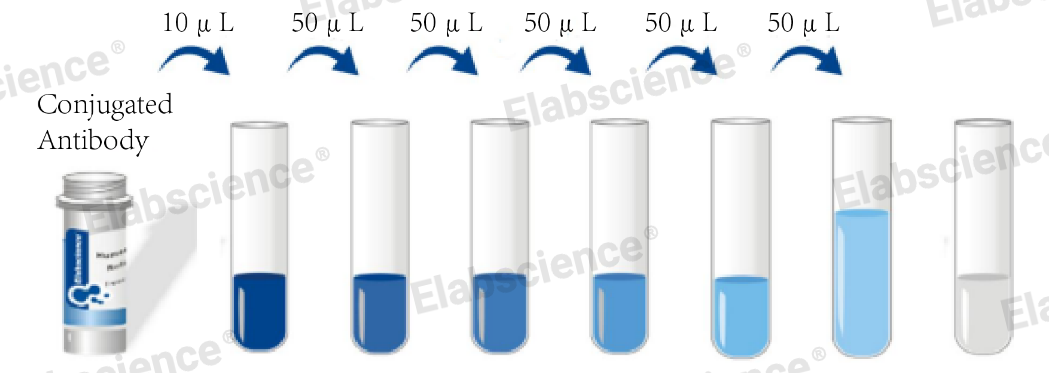
管1:10 µL抗体 + 90 µL稀释液
管2:从管1取50 µL抗体+ 50 µL稀释液
管3:从管2取50 µL抗体+ 50 µL稀释液
以此类推
管6:从管5取50 µL抗体+ 50 µL稀释液,混匀后取出50 µL抗体弃掉
管7:只加入50 µL稀释液,用来做空白对照
这样,你本次滴定只使用了2 µg抗体
③ 将要标记的细胞,事先用适量的Fc受体阻断剂,室温孵育10 min;
④ 向每管稀释好的抗体中,加入50 µL约1×106细胞,混匀,4°C避光孵育30 min;
⑤ 加入2 mL细胞染色缓冲液,轻轻混匀,300 g离心5 min;
⑥ 弃上清,用200 µL PBS重悬,上机检测,阳性细胞群至少获取500个事件。
4 如何计算滴定结果
一旦制定了滴定梯度,有几种方法可以评估数据以确定最佳滴定:
最简单的方法是计算SNR(信噪比),即阳性群体的MFI (中位荧光强度)与阴性群体的MFI的比率。如图所示,抗体CD4-FITC的最佳抗体使用浓度为0.7 μg/mL(1:800稀释)。
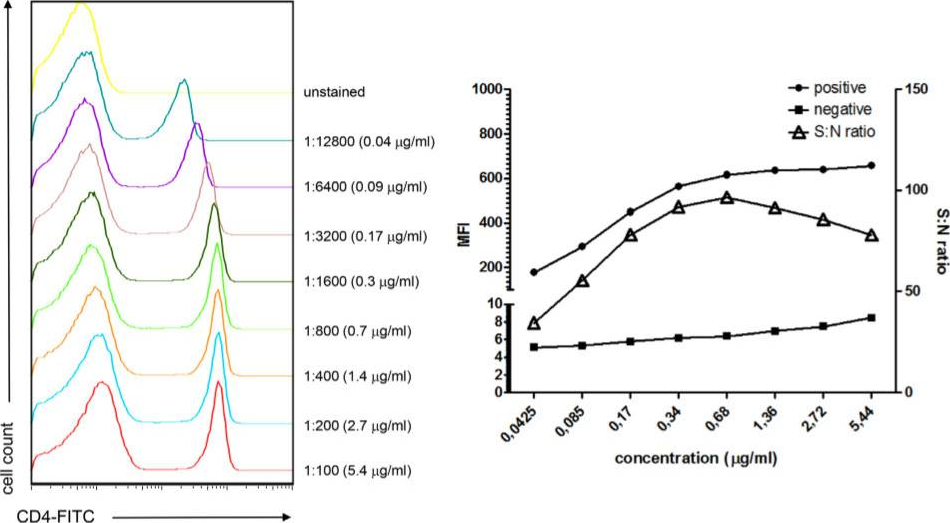
▲Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). Eur J Immunol. 2019 Oct; 49(10): 1457–1973.
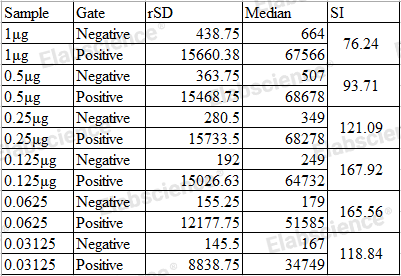
考虑到阴性群体的CV,另外一种方法就是计算染色指数(Staining Index,SI):
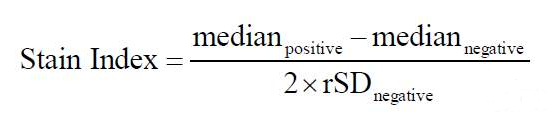
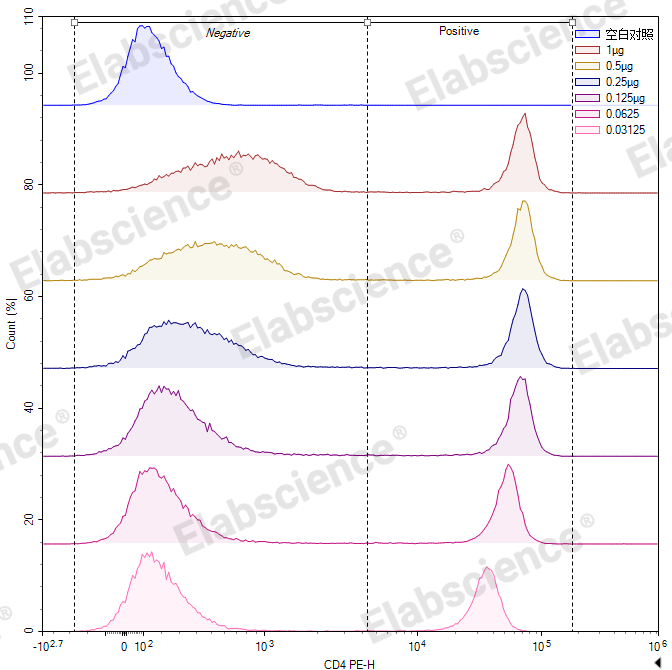
如图所示,抗体CD4-PE的抗体使用浓度为1.25 μg/mL时,染色指数最大,此时为最佳使用浓度。
5. 抗体滴定注意事项
① 对于一些全阳的细胞,滴定时可以在样本染色后加入未染色的细胞;
② 对于CD3、CD4、CD8这类分群明显且间隔非常开的指标,只做细胞性质确定设门用的时候,可不进行滴定,只滴定那些需要分析比例或MFI的指标;
③ 对于表达量比较少的稀有细胞群体,在染色时,可加入该群细胞的父级细胞群的抗体;
④ 如果样本中有大量的死细胞,在滴定过程中,要先加入死活染料区分死活,再确定目标抗体的浓度;
⑤ 在一定的细胞密度范围内,抗体的染色指数只与抗体的浓度有关,与细胞密度无关。
以上是本期文章分享的流式实验干货全部内容~

