高分文献解读
文献解读 | IF=15.1!基于糖酵解-氧化应激-自噬调控的仿生矿化纳米系统
黑色素瘤是一种好发于皮肤和黏膜的高度恶性肿瘤,该肿瘤进展程度快、恶性程度高,其高度糖酵解表型及高度侵袭转移性使中晚期治疗面对巨大挑战。因此,采用一种有效的策略,阻断糖酵解途径,提高氧化应激水平,抑制肿瘤的发展、迁移和侵袭,是成功治疗的关键。
本文由Chemical Engineering Journal一作、沈阳药科大学廉鹤供稿,从改变黑色素瘤细胞代谢及生物学行为角度出发,创新性构筑仿生矿化 LND-BSA@FePO4纳米反应器,用于实现多效协同治疗策略。
LND-BSA@FePO4在模拟体液中可实现LND及Fe3+的有效释放,Fe3+可进一步发生级联催化反应,消耗还原性谷胱甘肽生成Fe2+,继而与H2O2发生芬顿反应生成·OH。
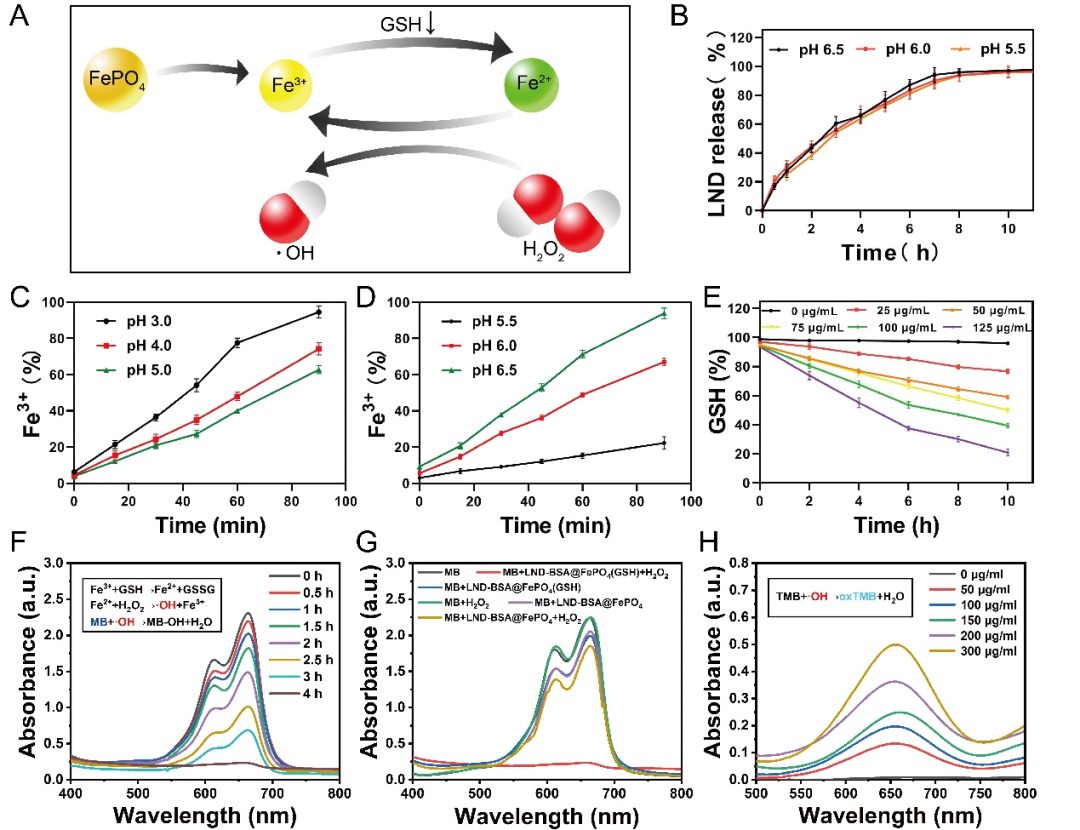
图1. (A)Fe3+与GSH生成Fe2+以及Fe2+与过氧化氢之间的Fenton反应的机理。(B) LND释放。在磷酸缓冲溶液(C)和柠檬酸缓冲溶液(D)中,Fe3+释放。(E)采用DTNB法检测到不同浓度的LND-BSA@FePO4存在下的GSH消耗量。(F)MB降解检测·OH产生。(H)以TMB为探针,检测·OH的产生。(n = 3, *P < 0.05, **P < 0.01, ***P < 0.001)
LND-BSA@FePO4在细胞水平的抗肿瘤效果。B16细胞经过不同浓度的LND-BSA@FePO4及其对照组培养12小时后,细胞死亡率与孵育浓度成正相关趋势,且LND-BSA@FePO4组的细胞杀伤作用最强,细胞增殖半抑制浓度为22.8 μg/mL,在最高给药浓度点细胞几乎完全死亡(图2A-E)。进一步采用Calcein-AM/PI 双染法对活细胞和死细胞进行荧光染色,在LND-BSA@FePO4组中出现明显的红色荧光,而绿色荧光信号几乎完全消失,表明多效协同效应诱导的B16细胞的致死率最高(图2F)。
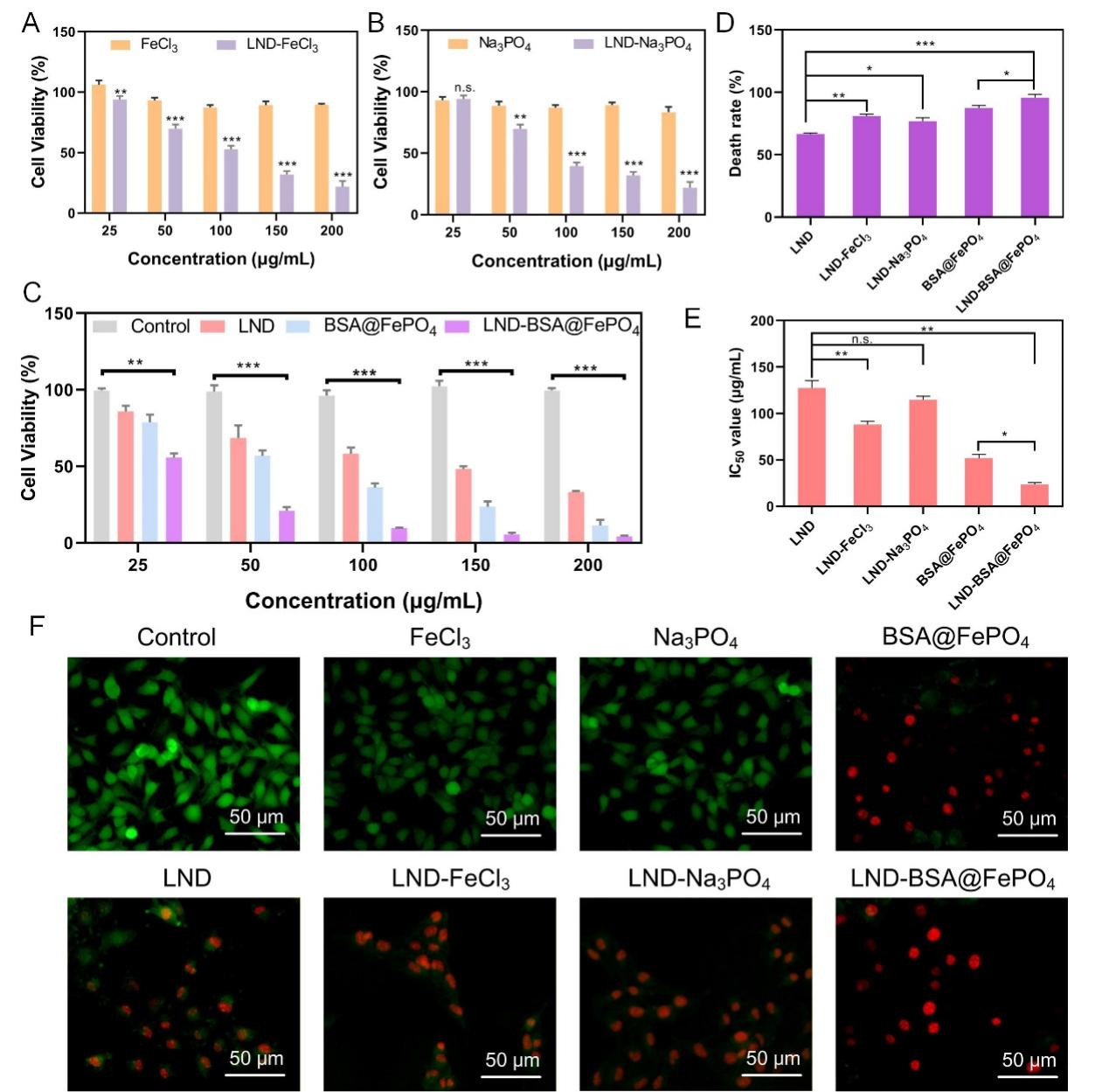
图2.(A-C)经不同组别处理后B16细胞的存活情况;(D)B16 细胞最高死亡率;(E)各组细胞 IC50 值;(F)活/死细胞荧光染色情况。(n = 3, *P < 0.05, **P < 0.01, ***P < 0.001)
进一步,我们研究了LND-BSA@FePO4的抗肿瘤机制。LND-BSA@FePO4中的LND作为己糖激酶(HK2)抑制剂调节糖酵解途径,切断细胞能量和生物合成的供应来源。为了验证肿瘤细胞糖酵解能力的变化,我们检测了细胞和培养基中的葡萄糖含量。LND对HK2的抑制导致细胞严重饥饿,进一步导致细胞葡萄糖摄取反馈增加,随着制剂浓度的增加,胞内葡萄糖含量累积而培养基中葡萄糖浓度降低(图3A、B)。然而此时的肿瘤细胞失去了利用葡萄糖的能力,我们使用L-乳酸(LA)比色法试剂盒(货号E-BC-K044-S,Elabscience Biotechnology Co.,Ltd)对细胞上清培养基中的乳酸水平进行检测,B16细胞经不同浓度的LND-BSA@FePO4培养12小时后,上清液培养基中的乳酸含量随制剂浓度的增加而减少,当给药浓度达到75 μg/mL时,培养基中细胞外排乳酸的含量降低至对照组的24.03%(图3C)。此外,WB分析检测到HK2表达下调,说明了LND-BSA@FePO4抑制糖酵解的作用(图3D)。
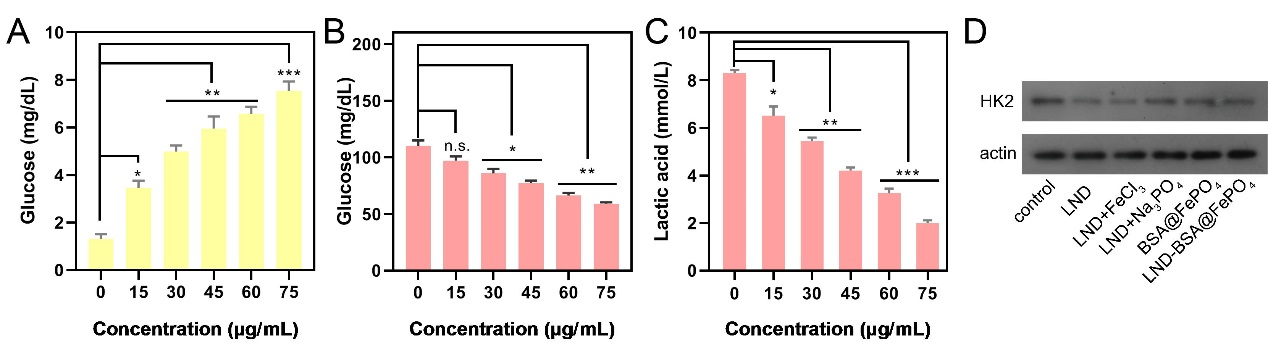
图3. B16细胞经不同浓度的LND-BSA@FePO4处理后的细胞内(A)及细胞上清培养基(B)中的葡萄糖含量,细胞上清中的乳酸含量(C);(D)经不同组别处理后HK2表达情况。(n = 3, *P < 0.05, **P < 0.01, ***P < 0.001)
仿生矿化磷酸铁在肿瘤酸性微环境中解离出Fe3+,Fe3+将还原性谷胱甘肽(GSH)转化为氧化性谷胱甘肽(GSSG),生成的Fe2+继续与过氧化氢发生Fenton反应,产生大量剧毒的羟基自由基(⋅OH),上调细胞内氧化应激水平,促进铁死亡的发生。首先使用总铁离子比色法试剂盒(货号E-BC-K772-M,Elabscience Biotechnology Co.,Ltd)分析细胞中的铁总量,总铁离子含量随着制剂浓度和孵育时间的增加而增加(图4 A、B)。此外,我们还检测到胞内GSH含量降低,脂质氧化产物MDA含量增多(图4C、D)。我们还探究了氧化应激的关键指标,细胞内总抗氧化能力下降,ROS产生增多,氧化应激相关蛋白Nrf2和HO-1在B16细胞中的表达均上调,表明细胞内氧化应激升高(图4 E-G)。接下来,WB分析检测到铁死亡关键蛋白GPX4下调,证明LND-BSA@FePO4有效诱导铁死亡。
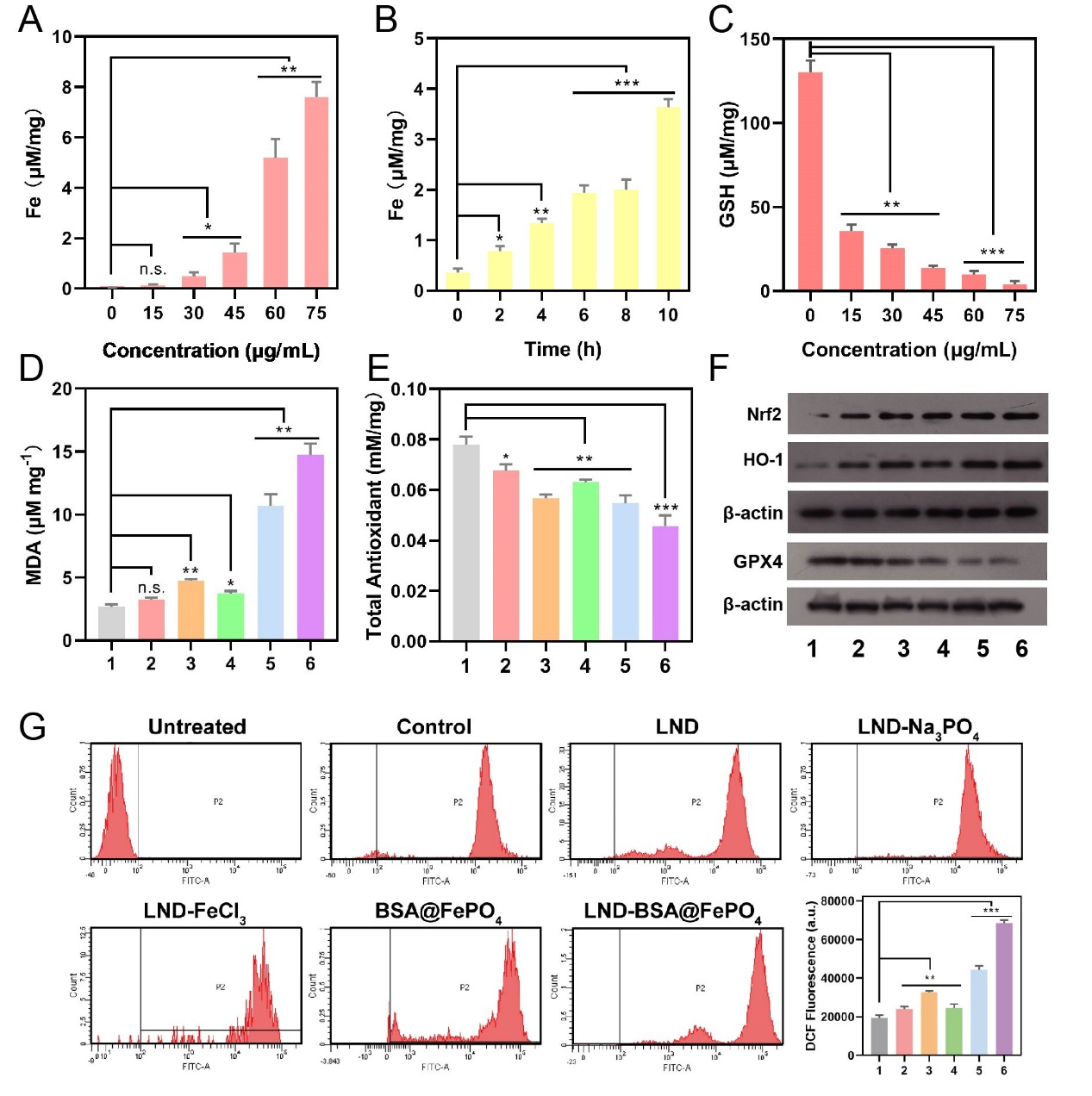
图4.(A)不同浓度的LND-BSA@FePO4处理后的胞内铁总量;(B)60μg/mL LND-BSA@FePO4孵育不同时间后的胞内铁总量;(C)胞内GSH含量;(D) 胞内MDA含量;(E) 胞内总抗氧化能力;(F) B16 细胞关键蛋白表达量;(G)不同组别处理后的细胞内ROS水平。(组别1: Control, 2: LND, 3: LND-FeCl3, 4: LND-Na3PO4, 5: BSA@FePO4, 6: LND-BSA@FePO4)(n = 3, *P < 0.05, **P < 0.01, ***P < 0.001)
矿化FePO4解离出的PO43-,可以消耗溶酶体内的大量的H+,形成共轭酸HPO42−,从而提高溶酶体的pH值和渗透压,阻止他们与自噬小体结合,阻止肿瘤保护性自噬,进而加速肿瘤细胞死亡的过程。使用生物透射电镜观察了细胞中的自噬情况,与对照组相比,LND-BSA@FePO4组自噬小体增加而自噬溶酶体减少,表明自噬途径被有效阻断(图5A)。WB分析中,晚期自噬标志物RAB7表达降低,LC3表达上调,LC3-II/LC3-I增大,内源性LC3-I向脂质形式LC3-II的转化表明肿瘤细胞中自噬小体数量增加,自噬底物p62表达上调,进一步表明自噬受到抑制,导致自噬小体和底物的积累(图5B)。
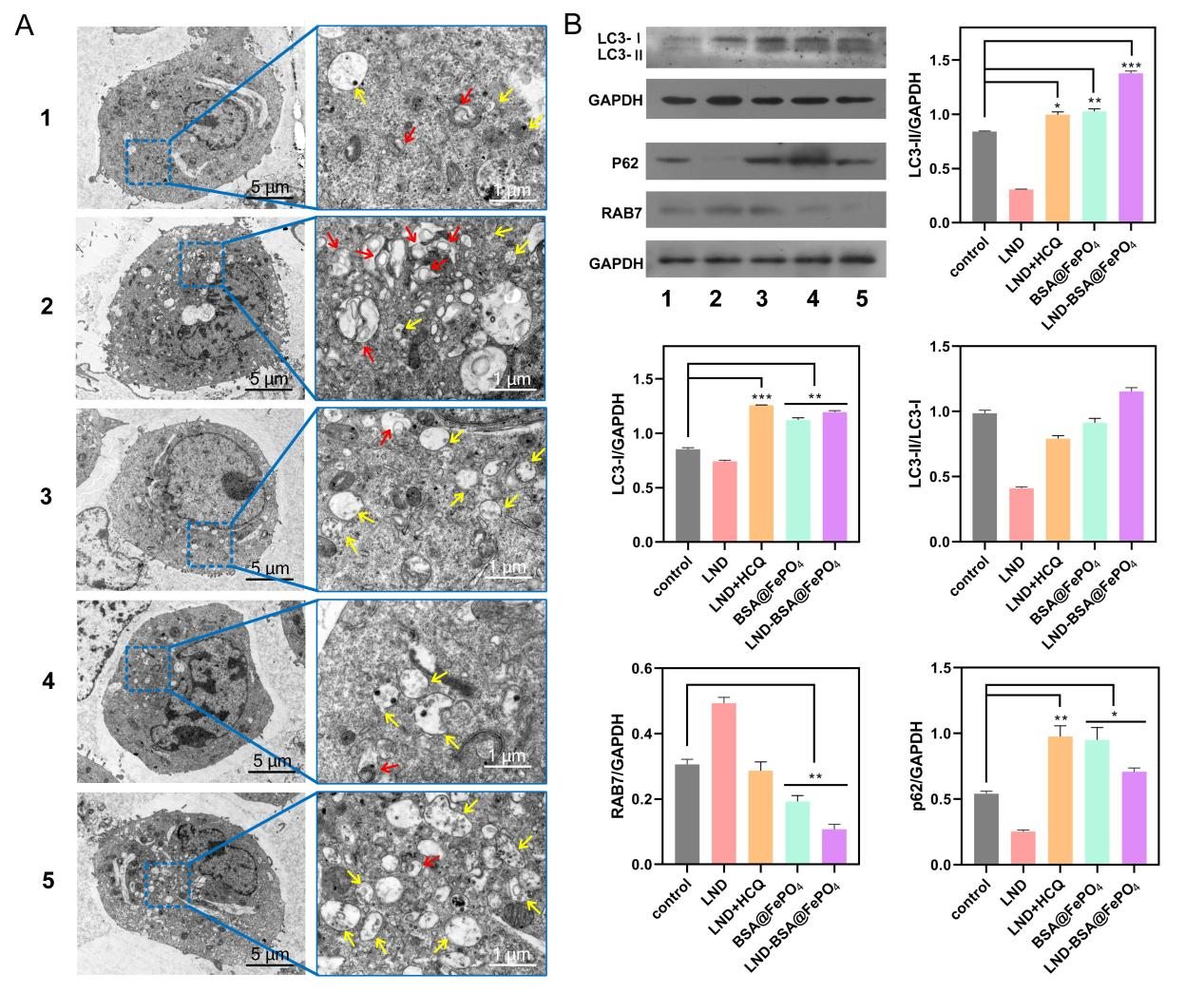
图5.(A)不同组别处理后的B16细胞的Bio-TEM图像。黄色箭头表示自噬小体,红色箭头表示自噬溶酶体。(B) B16 细胞自噬关键蛋白表达量及灰度分析。(组别1: Control, 2: LND, 3: LND-FeCl3, 4: LND-Na3PO4, 5: BSA@FePO4, 6: LND-BSA@FePO4)(n = 3, *P < 0.05, **P < 0.01, ***P < 0.001)
我们构建了 C57BL/6 小鼠皮下移植瘤模型(B16 细胞),用于综合评价纳米体系抗肿瘤效果。与对照组相比,LND-BSA@FePO4组有显著的抗肿瘤作用,肿瘤体积、肿瘤重量及肿瘤大小均明显降低,肺部转移结节减少,表明LND-BSA@FePO4能有效抑制黑色素瘤的发展和转移(图6)。
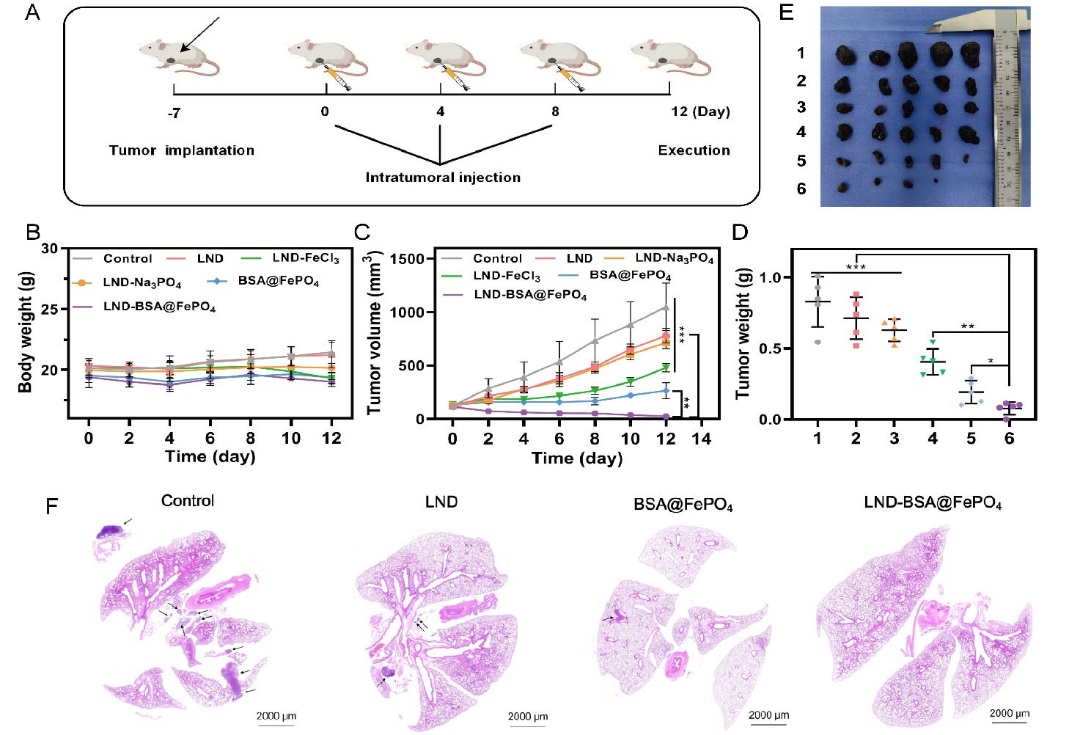
图6.(A)荷瘤鼠培养及处理方案;不同治疗后小鼠的体重(B)、肿瘤体积(C)、肿瘤重量(D)、典型肿瘤组织照片(E)。(F)不同组荷瘤小鼠肺转移的H&E图像。(组别1: Control, 2: LND, 3: LND-FeCl3, 4: LND-Na3PO4, 5: BSA@FePO4, 6: LND-BSA@FePO4)(n = 5, *P < 0.05, **P < 0.01, ***P < 0.001)
