专题论坛
铁死亡研究-诱导剂和抑制剂的分类与作用机制
铁死亡是近10年来热门的细胞死亡研究领域,其发生主要包含三方面的因素:
1.细胞中含有大量多不饱和脂肪酸侧链的磷脂
2.细胞内铁离子积累
3.细胞抗氧化体系受到抑制
经过近十年的研究,目前铁死亡调控途径简单总结如下图:
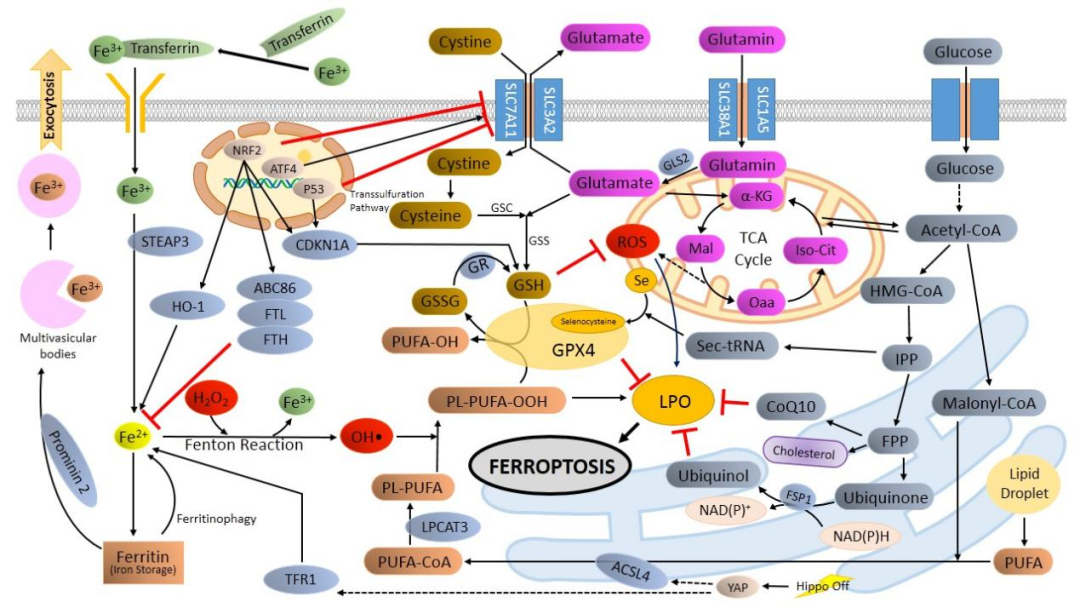
铁死亡通路图
大量铁死亡相关文献表明,铁死亡研究过程中,除了铁死亡常见特征指标的检测外,靶向不同途径的诱导剂和抑制剂也是必不可少的工具。
本期,我们整理了文献中常见的铁死亡诱导剂和抑制剂的分类及作用机制,供大家参考。
铁死亡诱导剂(FINS)✦ Ferroptosis inducers
根据不同的作用机制,目前已知的铁死亡诱导剂大致可分为四种类型:
1.抑制Xc-系统的I型(Class I FIN)
2. 抑制或降解GPX4的II型(Class II FIN);
3. 消耗辅酶Q10的III型(Class III FIN);
4. 通过铁或多不饱和脂肪酸(PUFA)过载诱导脂质过氧化的IV型(Class IV FIN)。
这四种类型对于铁死亡的诱导都具有较高的特异性,即:在诱导铁死亡的过程中,基本不会激活其他类型细胞死亡的标志物。
利用这些诱导剂开发药物及疗法,可以有效利用铁死亡清除靶细胞(例如癌细胞、炎症细胞、活化的成纤维细胞等),达到治疗疾病的目的。
|
类型 |
诱导剂 |
作用机制 |
|
I型 |
Erastin及衍生物 |
抑制Xc-胱氨酸摄取 |
|
金诺芬 |
抑制硫氧蛋白还原酶活性 |
|
|
偶氮磺胺吡啶 |
抑制胱氨酸摄取 |
|
|
对乙酰氨基酚 |
消耗细胞内谷胱甘肽 |
|
|
L-丁硫氨酸-(S,R)-亚砜亚胺 |
抑制细胞内谷胱甘肽生成 |
|
|
谷氨酸盐 |
通过抑制谷氨酸转出降低Xc-活性 |
|
|
II型 |
RSL3 |
在硒代半胱氨酸活性位点结合GPX4 |
|
FIN56 |
诱导GPX4降解 |
|
|
ML162 |
在硒代半胱氨酸活性位点结合GPX4 |
|
|
ML210 |
在硒代半胱氨酸活性位点结合GPX4 |
|
|
DPI10 |
抑制GPX4活性 |
|
|
DPI13 |
在其他位点结合GPX4 |
|
|
Altertamine |
抑制GPX4活性 |
|
|
顺铂 |
与GSH结合,使GPX4失活 |
|
|
III型 |
iFSP1 |
抑制FSP1活性,减少辅酶Q10生成 |
|
他汀类药物 |
抑制MVA途径 |
|
|
IV型 |
血红素 |
增加细胞内不稳定状态的铁 |
|
青蒿素 |
诱导铁蛋白自噬,释放不稳定态的铁 |
|
|
青蒿琥酯 |
诱导铁蛋白自噬,释放不稳定态的铁 |
|
|
帕拉提尼 |
增加转铁蛋白表达 |
|
|
FINO2 |
氧化亚铁离子,促进ROS积累,氧化PUFA |
|
|
BAY87-2243 |
抑制线粒体呼吸链复合物I,增加ROS积累 |
|
|
tBOOH |
氧化PUFA |
常见的铁死亡诱导剂及作用机制
铁死亡抑制剂 ✦ Ferroptosis inhibitors
目前常见的铁死亡抑制剂,主要针对铁死亡的两个重要特征:亚铁离子过载和脂质过氧化物(LPO)积累,通过减少游离铁、消除自由基、抑制脂质过氧化发挥作用。具体分类和试剂如下表:
|
类型 |
抑制剂 |
作用机制 |
|
铁螯合剂 |
去铁胺 |
减少细胞中不稳定铁,抑制芬顿反应 |
|
去铁酮 |
||
|
Deferasirox |
||
|
姜黄素 |
||
|
铁调素 |
||
|
抗氧化剂 |
Ferrostain-1 |
清除ROS,减少细胞中不稳定的铁 |
|
Liproxstain-1 |
清除ROS,激活Nrf2通路,恢复GPX4水平 |
|
|
Trolox |
抑制脂质过氧化 |
|
|
XJB-5-131 |
靶向线粒体清除ROS |
|
|
脂氧合酶(LOX)抑制剂 |
Zileuton |
抑制5-LOX |
|
AA861 |
||
|
PD146176 |
抑制15-LOX |
|
|
黄芩素 |
抑制12/15-LOX |
|
|
ACSL4抑制剂 |
Troglitazone |
抑制ACSL4功能,阻断PUFA的活化和磷脂化过程,减少脂质过氧化原料的生成 |
|
Rosiglitazone |
||
|
Pioglitazone |
||
|
氮氧化物 |
TEMPO |
阻断芬顿反应,抑制羟基自由基生成 |
|
PHOXNO |
||
|
硒补充 |
硒 |
补充GPX4丰度,增强脂质过氧化物清除能力 |
|
甲基硒代半胱氨酸 |
||
|
硒代胱胺 |
常见的铁死亡抑制剂及作用机制
铁死亡的研究目前刚刚进入第二个10年,选择性调控铁死亡的机制和方法,将是研究的热点及进展关键,在这一过程中,相应的诱导剂和抑制剂会起到至关重要的作用。
参考文献
1. S Sun, H Tu, L Tang, et al. Research progress in inducers and inhibitors or ferroptosis. China J Phar Toxi, 2020, 34(8): 623-633.
2. SJ Dixon, KM Lemberg, MR Lamprecht, et al. Ferroptosis: an iron-dependent form of non-apoptotic cell death. Cell, 2012, 149(5): 1060-1072.
3. K Shimada, R Skouta, A Kaplan, et al. Global survey of cell death mechanisms reveals metabolic regulation of ferroptosis. Nat Chem Bio, 2016, 12(7): 497-503.
4. W Yang, BR Stockwell. Synthetic lethal screening indentifies compounds activating iron-dependent, non-apoptotic cell death in oncogenic-RAS-harboring cancer cells. Chem Biol, 2008, 15(3): 234-245.
5. J Chen, X Li, C Ge, et al. The multifaceted role of ferroptosis in liver disease. Cell Death Differ, 2022, 29(1): 467-480.
6. TC Xie, X Song, X Sun, et al. Identification of baicalein as a ferroptosis inhibitor by natural product library screening. Biochem Biophys Res Comm, 2016, 473(4): 775-780.
7. M Guerrero, C Garcia, A Palominio, et al. Curcumin reduces renal damage associated with rhabdomyolysis by decreasing ferroptosis-mediated cell death. FASEB, 2019, 33(8): 8961-8975.
8. BR Stockwell. Ferroptosis turns 10: emerging mechanisms, physiological functions, and therapeutic applications. Cell, 2022, 185(7): 2401-2421.
下一个: 铁代谢对铁死亡的调控
